研究概要【病理部門】
教授:矢野博久
私共のグループの研究テーマは、肝発癌・発育過程でのcancer stem cellの同定解明と同定因子の早期診断マーカーへの有用性の検討である。癌の発生・進展において、従来、癌は単一クローン由来であり、癌細胞の脱分化により悪性度の高い癌細胞が生じ、癌が進展するというclonal evolution modelが提唱されていた。近年、癌幹細胞といった癌組織中の極少数の腫瘍形成能の高い癌細胞が発癌初期から存在し、幹細胞のように多分化能と自己複製を繰り返すことで、癌が形成されるというcancer stem cell model(癌幹細胞理論)が展開されている。癌幹細胞が肝癌発生初期から存在していれば、その同定解明は肝癌の早期診断マーカーの確立に有用である。しかし、癌幹細胞は、癌の脱分化など進展過程においても出現するのではないかというclonal evolution modelと癌幹細胞理論を組み合わせた仮説も提唱されており、肝癌における癌幹細胞の存在や起源には未だ不明な点が多いのが現状である。
肝癌の癌幹細胞は、他の癌と同様に肝臓の幹・前駆細胞の癌化に由来し、肝前駆細胞のマーカーを発現していると推察されているが、肝癌の1亜型である混合型肝癌では、癌幹細胞の有無に関係なく高頻度に肝前駆細胞のマーカーを発現する。このように、肝癌の癌幹細胞の存在、発生、マーカーに関して不明な点が多いが、癌幹細胞が薬剤抵抗性であることから、これらの細胞を早期に特定し完全に排除することが肝癌根治のためには必要である。
我々は、世界でもトップレベルの数である13種類の性状の異なる肝癌細胞株を独自に樹立・保持している。即ち、(ア)‘結節内結節像’を示す肝細胞癌より樹立された単クローン由来で分化度の異なる2つの肝細胞癌株、(イ)末期肝癌患者の腹水より樹立された3つの肝細胞癌株、(ウ)混合型肝癌の2つの株、及び(エ)外科切除された種々の分化度の肝細胞癌株6株を有しており、これらの肝癌細胞株を用いて段階的に肝癌における癌幹細胞の特徴を検討する。
Pathology Division
Overview of Research Activity
Hirohisa Yano
The aim of our research group is ‘Identification of hepatic cancer stem cell (CSC) during development and progression of liver cancer, and establishment of useful hepatic CSC markers for the early detection of liver cancer’. It was postulated that cancer cells are of monoclonal origin, and a morphologically less differentiated subpopulation arises due to clonal dedifferentiation in the tumor and closely relates to the evolution of cancer. This is called clonal evolution model. Recent evidence suggested CSC, a minority population with stem cell characteristics, closely relates to cancer development and progression. This is called CSC theory. If such CSC is present in the developmental process of liver cancer, the establishment of hepatic CSC markers is useful for the early diagnosis of liver cancer. However, it is speculated that hepatic CSC may also be produced by clonal dedifferentiation of liver cancer. At this moment, there are many unsolved problems regarding to the presence and origin of hepatic CSC.
Neoplastic change of stem cell is considered to produce CSCs in many cancers; therefore, CSCs express one or more of their unique stem cell markers. Similarly, hepatic CSCs are considered to expresses hepatic stem/progenitor cell marker(s). However, neoplastic cells expressing hepatic stem/progenitor markers are not always CSCs. Tumor cells of combined hepatocellular-cholangiocarcinoma (ChC), a subtype of liver cancer, often express hepatic progenitor cell markers without CSC features. Although the presence or origin of hepatic CSC is not clarified, it is important to find out a useful marker of hepatic CSC because the identification and eradication of drug-resistant hepatic CSC is essential to achieve a complete cure of liver cancer.
We have originally established 13 liver cancer cell lines in our institute. They consist of (1) two clonally related, morphologically and biologically distinct human hepatocellular carcinoma (HCC) cell lines established from a single nodule, (2) 3 HCC cell lines established from peritoneal effusion of patients in the terminal stage, (3) 2 ChC cell lines, and 6 HCC cells lines established from surgicall-resected HCC tissues showing different differentiation levels. We step by step investigate the presence, origin, and characteristics of hepatic CSC by using the 13 cell lines.
研究活動
結節内結節像を示す肝癌より樹立された高分化型及び低分化型肝癌細胞株におけるside population細胞の検討
主研究者:中山正道、秋葉純、小笠原幸子、中島収、
谷川健、真田咲子、草野弘宣、矢野博久
【目的】肝細胞癌(肝癌) は、早期は高分化型肝癌細胞が境界不明瞭な結節を形成し増殖するが、腫瘍の増大と伴に癌結節内により低分化な癌組織が脱分化により発生し肝癌の進展に関与すると考えられている。しかし、近年、癌組織中には少数の癌幹細胞(CSC)が存在し癌の発生・進展に大きく関連していると言う研究結果が種々の癌で報告されている。今回、肝癌の脱分化とCSCの関連について肝癌細胞株を用いて解明を試みた。
【方法】‘結節内結節’像を示す肝癌から樹立した高分化型肝癌株HAK-1Aと、その脱分化による発生が推察され、形態的に分化度が低く、生物学的悪性度が高い低分化型肝癌株HAK-1Bを実験に用いた。CSCの性状を示すとされている、Hoechst33342色素の排泄能が高く、レセルピン処理により消失する細胞集団であるside population(SP) 細胞とnon-SP細胞をFACSAria Ⅱを用いて分離し、肝癌のCSCマーカーの発現(CD90, EpCAM, CD133) やcDNA Microarrayによる遺伝子発現の分析を行った。また、増殖率、薬剤耐性(5-fluorouracil, IFN-α)、コロニー形成能、マウスの造腫瘍性に関してHAK-1BのSP細胞とnon-SP細胞で比較した。
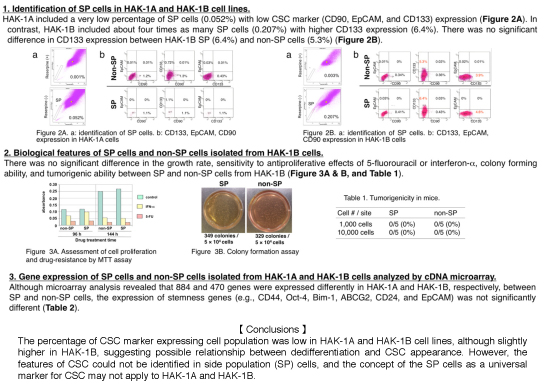
【成績】HAK-1AにおけるSP細胞の割合は低く(0.052%)、CD90, EpCAM, CD133陽性細胞率も低値(1.5%未満)であった。これに対して、HAK-1BはHAK-1Aの4倍のSP細胞(0.207%)が見られ、CD133陽性細胞を6.4%認めた。CD90及びEpCAM陽性細胞の陽性率は0.5%未満であった。HAK-1Bにおいて、CD133の陽性細胞率はSP細胞が6.4%でnon-SP細胞が5.3%で、有意差はみられなかった。また増殖率、5-fluorouracilやIFN-αの増殖抑制効果に対する感受性、コロニー形成能力、マウスの腫瘍形成能にもSP細胞とnon-SP細胞で有意な差はみられなかった。Microaray解析を用いて、SP細胞とnon-SP細胞の間で遺伝子発現を比較すると、HAK-1Aで884個、HAK-1Bで470個の遺伝子に発現量の変化が見られたが、stemness gene(CD44, Oct-4, Bim-1, ABCG2, CD24, EpCAMなど) の発現に有意差はみられなかった。
【考案・結論】HAK-1AとHAK-1Bにおいて、SP細胞の割合やCSCのマーカーの発現は低かったが、HAK-1Bにおいて若干高く、脱分化とCSCの出現との関係が示唆された。しかし、CSCの特徴が分離されたSP細胞で不明瞭であり、SP細胞がCSCの普遍的なマーカーであると言う概念はHAK-1AとHAK-1Bでは適合しない可能性が示唆された。
Cancer stem cell marker expressing cell population in two clonally related, morphologically and biologically distinct human hepatocellular carcinoma cell lines established from a single nodule
Aim: Hepatocellular carcinomas (HCCs) are well-differentiated and vaguely nodular in the early stage. Subsequently, a morphologically less differentiated HCC subpopulation arises due to clonal dedifferentiation in the tumor and closely relates to the evolution of HCC. Recent evidence suggested cancer stem cell (CSC), a minority population with stem cell characteristics, closely relates to cancer development and progression. The aim of this study is to clarify the relationship between the clonal dedifferentiation and the CSC in HCC.
Materials and Methods: We used a well-differentiated human HCC cell line (HAK-1A) and a poorly differentiated HCC cell line (HAK-1B) established from a single nodule with histological heterogeneity. Previous studies (Yano et al. Hepatology, 1993) revealed that the two cell lines are of clonal origin, but that HAK-1B is more aggressive biologically than HAK-1A; therefore, we speculate HAK-1B arose due to clonal dedifferentiation of HAK-1A. The side population (SP) cells, which is enriched for stem cells and is defined as the reserpine-blockable ability to efflux Hoechst 33342 dye, as well as non-SP cells were isolated from the 2 cell lines with a FACSAria II and used for the analyses of the hepatic cancer stem cell marker (CD90, EpCAM, and CD133) expression, and gene expression by a cDNA Microarray. Growth rate, drug resistance, colony forming ability, and tumorigenicity were compared between SP and non-SP cells from HAK-B.
Results: HAK-1A included a very low percentage of SP cells (0.052%), and ‹1.5% of CD90+, EpCAM⁺, or CD133+ cells. In contrast, HAK-1B cells included about four times as many SP cells (0.207%) as HAK-1A, 6.4% of CD133+ cells, ‹0.5% of CD90+ or EpCAM+ cells. There was no definite difference in CD133 expression between SP (6.4%) and non-SP cells (5.3%) isolated from HAK-1B. There was no significant difference in the growth rate, sensitivity to antiproliferative effects of 5-fluorouracil or interferon-alpha, colony forming ability, and tumorigenic ability between SP and non-SP cells from HAK-1B. Although microarray analysis revealed that 884 and 470 genes were differently expressed in HAK-1A and HAK-1B, respectively, between SP and non-SP cells, the expression of stemness genes (e.g., CD44, Oct-4, Bim-1, ABCG2, CD24, and EpCAM) was not significantly different.
Conclusions: The percentage of CSC marker expressing cell population was low, but was slightly higher in HAK-1B, suggesting some relationship between dedifferentiation and CSC appearance. However, the features of CSC could not be identified in SP cells, and the concept of the SP cells as a universal marker for CSC may not apply to HAK-1A and HAK-1B.